艾米迈托赛是一款间充质干细胞(MSC)治疗药物,间充质干细胞具有自我复制、低免疫原性、高活性、抑炎性和不成瘤性等特性。这些特点使得艾米迈托赛在再生医学和免疫治疗领域具有广阔的应用前景。通过输注间充质干细胞,它能够在体内发挥治疗作用,为患者带来改善病情的可能。
无论是国内还是国外,间充质干细胞都是干细胞疗法中最为热门的分类,Insight 数据库显示,当前全球已有 655 个间充质干细胞项目进入临床研发阶段(递交 IND 及以上),在各类干细胞疗法中遥遥领先。
全球 IND 及以上阶段干细胞疗法类别分布
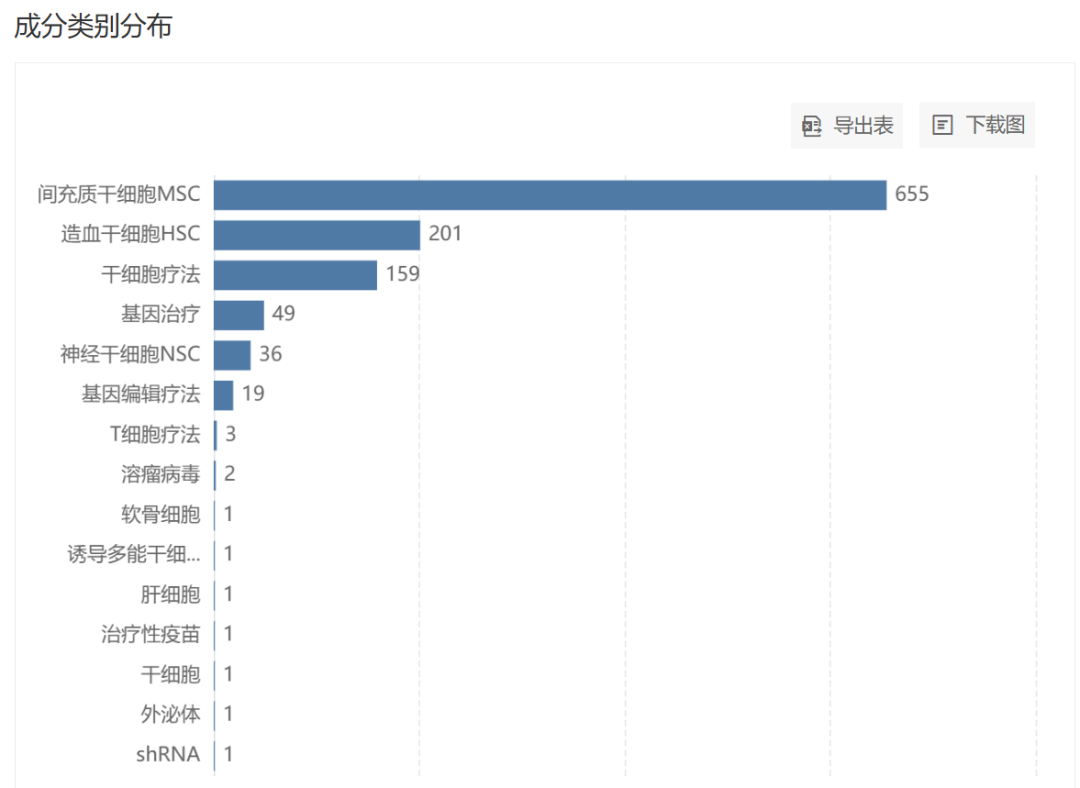
截图来自:Insight 数据库网页版
就在不久前的 2024 年 12 月 18 日,美国食品药品监督管理局(FDA)首开先河,批准了首款间充质基质细胞(MSC)疗法Ryoncil (remestemcel),用于治疗2个月及以上儿童患者的类固醇难治性急性移植物抗宿主病(SR-aGVHD)。
Remestemcel-L早在 2012 年和 2016 年就在加拿大、新西兰和日本获批上市,而在美国却历经了 5 年半的上市申请历程,期间受到两份 CRL,屡败屡战,终获成功。
而艾米迈托赛的研发之路也同样充满艰辛与挑战。早在2013年3月,它就在国内递交了新药临床研究申请(IND),但由于干细胞疗法的复杂性以及监管要求的严格性,研发进程较为缓慢。直到2020年6月,才首次公示临床试验。此后,研发团队持续优化药品性能,经过一系列严格的临床试验评估,最终在2024年成功获批上市。这一路走来,凝聚了无数科研人员的心血,也彰显了我国在干细胞治疗领域不断探索的坚定决心。
目前,艾米迈托赛已完成II期临床试验,III期临床试验正在进行中。在II期临床试验中,虽然在第28天时,间充质干细胞(MSCs)组与安慰剂组相比客观缓解率(ORR)未显示出显著性差异的 ORR(60% vs 50%),但在平均2周后,MSCs逐渐展现出治疗效果,尤其是对于完成8次输注的肠道受累患者,可能从中获益更多。
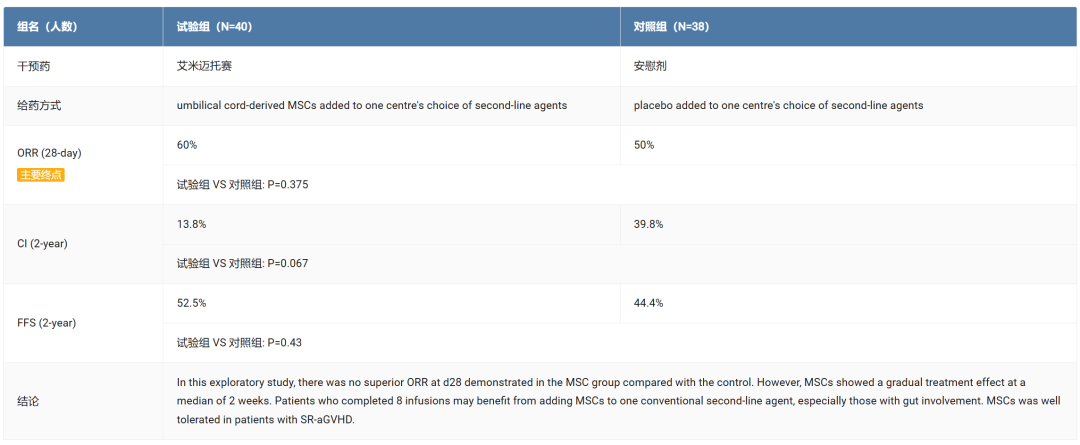
截图来自:Insight 数据库网页版
干细胞疗法在国内经历了漫长而曲折的发展历程。尽管首款产品的临床申请早在 2004 年就已经发生,但研发进度却极为缓慢。
直至 2017 年度末,原 CFDA 发布了《细胞治疗产品研究与评价技术指导原则(试行)》,明确了细胞制品作为药品的研发、注册和监管程序。沉寂已久的干细胞疗法作为其中之一,再次被带动进入踊跃研发阶段。
2020 年至 2024 年,CDE 又先后发布了 4 份干细胞相关技术指导原则,尤其在 2024 年发布《间充质干细胞防治移植物抗宿主病临床试验技术指导原则》之后,间充质干细胞的首个 NDA 申请和首张生产许可都在同年发生。
据 Insight 数据库显示,干细胞疗法在国内的 I 期临床试验启动高峰在 2019 年度,而 IND 申请则在 2023 年爆发。
中国内地干细胞疗法临床研发趋势

截图来自:Insight 数据库网页版
注:[成分类别] = [干细胞疗法];[中国内地最高进度] = [申报临床] 及以上
图片与文字内容来自第三方 如有侵权请联系删除

